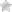ПСС — комплекс анатомических образований сердца (узлов, пучков и волокон), состоящих из атипичных мышечных волокон (сердечные проводящие мышечные волокна) и обеспечивающих координированную работу разных отделов сердца (предсердий и желудочков), направленную на обеспечение нормальной сердечной деятельности.
Синусовый узел также называется водителем ритма и представляет собой образование размером около 15 х 3 мм, располагающееся в стенке правого предсердия. Импульсы, возникающие в этом месте, передаются на близлежащие сократительные клетки миокарда и распространяются до следующего участка проводящей системы сердца – до атриовентрикулярного узла. Синусовый узел способствует сокращению предсердий в определенном ритме – с частотой 60-90 сокращений в минуту. Сокращение желудочков в таком же ритме осуществляется путем проведения импульсов по атриовентрикулярному узлу и пучку Гиса.
Регуляция деятельности синусового узла тесно связана с вегетативной нервной системой, представленной симпатическими и парасимпатическими нервными волокнами, осуществляющими регуляцию всех внутренних органов. Последние волокна представлены блуждающим нервом, замедляющим частоту и силу сердечных сокращений. Симпатические волокна же, наоборот, ускоряют ритм и увеличивают силу сокращений миокарда. Вот почему замедление (брадикардия) и учащение (тахикардия) ритма сердца возможно у практически здоровых лиц с вегето-сосудистой дистонией, или вегетативной дисфункцией – нарушением нормальной координации вегетативной нервной системы.
Если же речь идет о поражении именно сердечной мышцы, то возможно развитие патологического состояния, называемого дисфункцией (ДСУ), или синдромом слабости синусового узла (СССУ). Данные понятия не являются практически равнозначными, но в целом речь идет об одном и том же – о брадикардии с различной степенью выраженности, способной вызвать катастрофическое снижение кровотока в сосудах внутренних органов, и, в первую очередь, головного мозга.
Общий план строения системы органов кровообращения. Системный и легочный круги кровообращения
Кровообращение — это непрерывное движение крови по замкнутой сердечно-сосудистой системе, обеспечивающее обмен газов в легких и тканях тела.
Помимо обеспечения тканей и органов кислородом и удаления из них углекислоты, кровообращение доставляет к клеткам питательные вещества, воду, соли, витамины, гормоны и удаляет конечные продукты обмена веществ, а также поддерживает постоянство температуры тела, обеспечивает гуморальную регуляцию и взаимосвязь органов и систем органов в организме.
Система органов кровообращения состоит из сердца и кровеносных сосудов, пронизывающих все органы и ткани тела.
Кровообращение начинается в тканях, где совершается обмен веществ через стенки капилляров. Кровь, отдавшая кислород органам и тканям, поступает в правую половину сердца и направляется им в малый (легочной) круг кровообращения, где кровь насыщается кислородом, возвращается к сердцу, поступая в левую его половину, и вновь разносится по всему организму (большому кругу кровообращения).
Сердце — главный орган системы кровообращения. Оно представляет собой полый мышечный орган, состоящий из четырех камер: двух предсердий (правого и левого), разделенных межпредсердной перегородкой, и двух желудочков (правого и левого), разделенных межжелудочковой перегородкой. Правое предсердие сообщается с правым желудочком через трехстворчатый, а левое предсердие с левым желудочком — через двустворчатый клапан. Масса сердца взрослого человека в среднем около 250 г у женщин и около 330 г у мужчин. Длина сердца 10-15 см, поперечный размер 8-11 см и переднезадний — 6-8,5 см. Объем сердца у мужчин в среднем равен 700-900 см3, а у женщин — 500-600 см3.
Наружные стенки сердца образованы сердечной мышцей, которая по структуре сходна с поперечнополосатыми мышцами. Однако сердечная мышца отличается способностью автоматически ритмично сокращаться благодаря импульсам, возникающим в самом сердце независимо от внешних воздействий (автоматия сердца).
Функция сердца состоит в ритмичном нагнетании в артерии крови, приходящей к нему по венам. Сердце сокращается около 70-75 раз в минуту в состоянии покоя организма (1 раз за 0,8 с). Более половины этого времени оно отдыхает — расслабляется. Непрерывная деятельность сердца складывается из циклов, каждый из которых состоит из сокращения (систола) и расслабления (диастола).
Различают три фазы сердечной деятельности:
- сокращение предсердий — систола предсердий — занимает 0,1 с
- сокращение желудочков — систола желудочков — занимает 0,3 с
- общая пауза — диастола (одновременное расслабление предсердий и желудочков) — занимает 0,4 с
Таким образом, в течение всего цикла предсердия работают 0,1 с и отдыхают 0,7 с, желудочки работают 0,3 с и отдыхают 0,5 с. Этим объясняется способность сердечной мышцы работать, не утомляясь, в течение всей жизни. Высокая работоспособность сердечной мышцы обусловлена усиленным кровоснабжением сердца. Примерно 10 % крови, выбрасываемой левым желудочком в аорту, поступает в отходящие от нее артерии, которые питают сердце.
Артерии — кровеносные сосуды, несущие обогащенную кислородом кровь от сердца к органам и тканям (лишь легочная артерия несет венозную кровь).
Стенка артерии представлена тремя слоями: наружной соединительнотканной оболочкой; средней, состоящей из эластических волокон и гладких мышц; внутренней, образованной эндотелием и соединительной тканью.
У человека диаметр артерий колеблется от 0,4 до 2,5 см. Общий объем крови в артериальной системе составляет в среднем 950 мл. Артерии постепенно древовидно ветвятся на все более мелкие сосуды — артериолы, которые переходят в капилляры.
Капилляры (от лат. «капиллюс» — волос) — мельчайшие сосуды (средний диаметр не превышает 0,005 мм, или 5 мкм), пронизывающие органы и ткани животных и человека, имеющих замкнутую кровеносную систему. Они соединяют мелкие артерии — артериолы с мелкими венами — венулами. Через стенки капилляров, состоящие из клеток эндотелия, происходит обмен газов и других веществ между кровью и различными тканями.
Вены — кровеносные сосуды, несущие насыщенную углекислым газом, продуктами обмена веществ, гормонами и другими веществами кровь от тканей и органов к сердцу (исключение легочные вены, несущие артериальную кровь). Стенка вены значительно тоньше и эластичнее стенки артерии. Мелкие и средние вены снабжены клапанами, препятствующими обратному току крови в этих сосудах. У человека объем крови в венозной системе составляет в среднем 3200 мл.
Кровообращение человека — замкнутый сосудистый путь, обеспечивающий непрерывный ток крови, несущий клеткам кислород и питание, уносящий углекислоту и продукты метаболизма. Состоит из двух последовательно соединённых кругов (петель), начинающихся желудочками сердца и впадающих в предсердия:
1. большой круг кровообращения начинается в левом желудочке и оканчивается в правом предсердии;
2. малый круг кровообращения начинается в правом желудочке и оканчивается в левом предсердии.
Большой (системный) круг кровообращения
Начинается из левого желудочка, выбрасывающего во время систолы кровь в аорту. От аорты отходят многочисленные артерии, в результате кровоток распределяется согласно сегментарному строению по сосудистым сетям, обеспечивая подачу кислорода и питательных веществ всем органам и тканям. Дальнейшее деление артерий происходит на артериолы и капилляры. Общая площадь поверхности всех капилляров в организме человека примерно 1500 м2.
Через тонкие стенки капилляров артериальная кровь отдаёт клеткам тела питательные вещества и кислород, а забирает от них углекислый газ и продукты метаболизма, попадает в венулы становясь венозной. Венулы собираются в вены. К правому предсердию подходят две полые вены: верхняя и нижняя, которыми заканчивается большой круг кровообращения. Время прохождения крови по большому кругу кровообращения составляет 24 секунды.
Функции
Кровоснабжение всех органов организма человека, в том числе лёгких.
Малый (лёгочный) круг кровообращения
Начинается в правом желудочке, выбрасывающем венозную кровь в лёгочный ствол. Лёгочный ствол делится на правую и левую лёгочные артерии. Лёгочные артерии дихотомически делятся на долевые, сегментарные и субсегментарные артерии. Субсегментарные артерии делятся на артериолы, распадающиеся на капилляры. Отток крови идет по венам, которые собираются в обратном порядке и в количестве четырёх штук впадают в левое предсердие, где заканчивается малый круг кровообращения. Кругооборот крови в малом круге кровообращения происходит за 4-5 секунд.
Функции
Основная задача малого круга газообмен в лёгочных альвеолах и теплоотдача.
Распределение крови через сосудистую сеть по всему телу регулируется нервной системой. Между клетками человеческого тела находятся незначительные промежутки, заполненные тканевой жидкостью, называемой тканевой лимфой. Из тканевой жидкости, клетки и ткани непрерывно получают необходимые им кислород и питательные вещества. В нее же поступают выделяемые клетками и тканями углекислота и продукты распада.
Для того чтобы обмен веществ происходил нормально, в тканевую жидкость должны все время поступать кислород и питательные вещества, а углекислота и продукты обмена веществ должны из нее непрерывно удаляться.
Такое постоянство состава тканевой жидкости имеет место благодаря кровообращению и непрерывному обмену, происходящему между кровью и тканевой жидкостью.
Физиологические свойства и особенности сердечной мышцы
Кровь может выполнять свои многочисленные функции, только находясь в постоянном движении. Обеспечение движения крови является главной функцией сердца и сосудов, формирующих кровеносную систему. Сердечно-сосудистая система совместно с кровью участвует также в транспорте веществ, терморегуляции, реализации иммунных реакций и гуморальной регуляции функций организма. Движущая сила кровотока создастся за счет работы сердца, которое выполняет функцию насоса.
Способность сердца сокращаться в течение всей жизни без остановки обусловлена рядом специфических физических и физиологических свойств сердечной мышцы. Сердечная мышца уникальным образом сочетает в себе качества скелетной и гладкой мускулатуры. Так же как и скелетные мышцы, миокард способен интенсивно работать и быстро сокращаться. Так же как и гладкие мышцы, он практически неутомим и не зависит от волевого усилия человека.
Физические свойства
Растяжимость — способность увеличивать длину без нарушения структуры под влиянием растягивающей силы. Такой силой является кровь, наполняющая полости сердца во время диастолы. От степени растяжения мышечных волокон сердца в диастолу зависит сила их сокращения в систолу.
Эластичность — способность восстанавливать исходное положение после прекращения действия деформирующей силы. Эластичность сердечной мышцы является полной, т.е. она полностью восстанавливает исходные показатели.
Способность развивать силу в процессе сокращения мышцы.
Физиологические свойства
Сокращения сердца происходят вследствие периодически возникающих процессов возбуждения в сердечной мышце, которая обладает рядом физиологических свойств: автоматизмом, возбудимостью, проводимостью, сократимостью.
Способность сердца ритмически сокращаться под влиянием импульсов, возникающих в нем самом, носит название автоматизм.
В сердце различают сократительную мускулатуру, представленную поперечно-полосатой мышцей, и атипическую, или специальную ткань, в которой возникает и проводится возбуждение. Атипическая мышечная ткань содержит малое количество миофибрилл, много саркоплазмы и не способна к сокращению. Она представлена скоплениями в определенных участках миокарда, которые образуют проводящую систему сердца, состоящую из синоатриального узла, располагающегося на задней стенке правого предсердия у места впадения полых вен; атриовентрикулярного, или предсердно-желудочкового узла, находящегося в правом предсердии вблизи перегородки между предсердиями и желудочками; предсердно-желудочкового пучка (пучка Гиса), отходящего от атриовентрикулярного узла одним стволом. Пучок Гиса, пройдя через перегородку между предсердиями и желудочками, разветвляется на две ножки, идущие к правому и левому желудочкам. Заканчивается пучок Гиса в толще мышц волокнами Пуркинье.
Синоатриальныи узел является водителем ритма первого порядка. В нем возникают импульсы, которые определяют частоту сокращений сердца. Он генерирует импульсы со средней частотой 70-80 импульсов в 1 мин.
Атриовентрикулярный узел — водитель ритма второго порядка.
Пучок Гиса — водитель ритма третьего порядка.
Волокна Пуркинье — водители ритма четвертого порядка. Частота возбуждения, возникающая в клетках волокон Пуркинье, очень низкая.
В норме атриовентрикулярный узел и пучок Гиса являются только передатчиками возбуждений из ведущего узла к сердечной мышце.
Однако и они обладают автоматизмом, только в меньшей степени, и этот автоматизм проявляется лишь при патологии.
Дополнительно
К основным особенностям сердечной мышцы относятся автоматия, возбудимость, проводимость, сократимость, рефрактерность.
Автоматия сердца — способность к ритмическому сокращению миокарда под влиянием импульсов, которые появляются в самом органе.
В состав сердечной поперечнополосатой мышечной ткани входят типичные сократительные мышечные клетки — кардиомиоциты и атипические сердечные миоциты (пейсмекеры), формирующие проводящую систему сердца, которая обеспечивает автоматизм сердечных сокращений и координацию сократительной функции миокарда предсердий и желудочков сердца. Первый синусно-предсердный узел проводящей системы является главным центром автоматизма сердца — пейсмекером первого порядка. От этого узла возбуждение распространяется на рабочие клетки миокарда предсердий и по специальным внутрисердечным проводящим пучкам достигает второго узла — предсердно-желудочкового (атриовентрикулярного), который также способен генерировать импульсы. Этот узел является пейсмекером второго порядка. Возбуждение через предсердно-желудо-ковый узел в нормальных условиях возможно только в одном направлении. Ретроградное проведение импульсов невозможно.
Третий уровень, который обеспечивает ритмичную деятельность сердца, расположен в пучке Гиса и волокнах Пуркине.
Центры автоматики, расположенные в проводящей системе желудочков, называются пейсмекерами третьего порядка. В обычных условиях частоту активности миокарда всего сердца в целом определяет синусно-предсердный узел. Он подчиняет себе все нижележащие образования проводящей системы, навязывает свой ритм.
Необходимым условием для обеспечения работы сердца является анатомическая целостность его проводящей системы. Если в пейсмекере первого порядка возбудимость не возникает или блокируется его передача, роль водителя ритма берет на себя пейсмекер второго порядка. Если же передача возбудимости к желудочкам невозможна, они начинают сокращаться в ритме пейсмекеров третьего порядка. При поперечной блокаде предсердия и желудочки сокращаются каждый в своем ритме, а повреждение водителей ритма приводит к полной остановке сердца.
Возбудимость сердечной мышцы возникает под влиянием электрических, химических, термических и других раздражителей мышцы сердца, которая способна переходить в состояние возбуждения. В основе этого явления лежит отрицательный электрический потенциал в первоначальном возбужденном участке. Как и в любой возбудимой ткани, мембрана рабочих клеток сердца поляризована. Снаружи она заряжена положительно, а внутри отрицательно. Это состояние возникает в результате разной концентрации Na+ и К+ по обе стороны мембраны, а также в результате разной проницаемости мембраны для этих ионов.
В состоянии покоя через мембрану кардиомиоцитов не проникают ионы Na+, а только частично проникают ионы К+. Вследствие диффузии ионы К+, выходя из клетки, увеличивают положительный заряд на ее поверхности. Внутренняя сторона мембраны при этом становится отрицательной. Под влиянием раздражителя любой природы в клетку поступает Na+. В этот момент на поверхности мембраны возникает отрицательный электрический заряд и развивается реверсия потенциала. Амплитуда потенциала действия для сердечных мышечных волокон составляет около 100 мВ и более. Возникший потенциал деполяризует мембраны соседних клеток, в них появляются собственные потенциалы действия — происходит распространение возбуждения по клеткам миокарда.
Потенциал действия клетки рабочего миокарда во много раз продолжительнее, чем в скелетной мышце.
Во время развития потенциала действия клетка не возбуждается на очередные стимулы. Эта особенность важна для функции сердца как органа, так как миокард может отвечать только одним потенциалом действия и одним сокращением на повторные его раздражения. Все это создает условия для ритмичного сокращения органа.
Таким образом происходит распространение возбуждения в целом органе. Этот процесс одинаков в рабочем миокарде и в водителях ритма. Возможность вызвать возбуждение сердца электрическим током нашла практическое применение в медицине. Под влиянием электрических импульсов, источником которых являются электростимуляторы, сердце начинает возбуждаться и сокращаться в заданном ритме. При нанесении электрических раздражении независимо от величины и силы раздражения работающее сердце не ответит, если это раздражение будет нанесено в период систолы, что соответствует времени абсолютного рефракторного периода. А в период диастолы сердце отвечает новым внеочередным сокращением — экстрасистолой, после которой возникает продолжительная пауза, называемая компенсаторной.
Проводимость сердечной мышцы заключается в том, что волны возбуждения проходят по ее волокнам с неодинаковой скоростью. Возбуждение по волокнам мышц предсердий распространяется со скоростью 0,8—1,0 м/с, по волокнам мышц желудочков — 0,8—0,9 м/с, а по специальной ткани сердца — 2,0—4,2 м/с. По волокнам скелетной мышцы возбуждение распространяется со скоростью 4,7—5,0 м/с.
Сократимость сердечной мышцы имеет свои особенности в результате строения органа. Первыми сокращаются мышцы предсердий, затем сосочковые мышцы и субэндокардиальный слой мышц желудочков. Далее сокращение охватывает и внутренний слой желудочков, которое обеспечивает тем самым движение крови из полостей желудочков в аорту и легочный ствол.
Изменения сократительной силы мышцы сердца, возникающие периодически, осуществляются при помощи двух механизмов саморегуляции: гетерометрического и гомеометрического.
В основе гетерометрического механизма лежит изменение исходных размеров длины волокон миокарда, которое возникает при изменении притока венозной крови: чем сильнее сердце расширено во время диастолы, тем оно сильнее сокращается во время систолы (закон Франка— Старлинга). Объясняется этот закон следующим образом. Сердечное волокно состоит из двух частей: сократительной и эластической. Во время возбуждения первая сокращается, а вторая растягивается в зависимости от нагрузки.
Гомеометрический механизм основан на непосредственном действии биологически активных веществ (таких, как адреналин) на метаболизм мышечных волокон, выработку в них энергии. Адреналин и норадреналин увеличивают вход Са^ в клетку в момент развития потенциала действия, вызывая тем самым усиление сердечных сокращений.
Рефрактерность сердечной мышцы характеризуется резким снижением возбудимости ткани на протяжении ее активности. Различают абсолютный и относительный рефракторный период. В абсолютном рефракторном периоде, при нанесении электрических раздражении, сердце не ответит на них раздражением и сокращением. Период рефрактерности продолжается столько, сколько продолжается систола. Во время относительного рефракторного периода возбудимость сердечной мышцы постепенно возвращается к первоначальному уровню. В этот период сердечная мышца может ответить на раздражитель сокращением сильнее порогового. Относительный рефракторный период обнаруживается во время диастолы предсердий и желудочков сердца. После фазы относительной рефрактерности наступает период повышенной возбудимости, который по времени совпадает с диастолическим расслаблением и характеризуется тем, что мышца сердца отвечает вспышкой возбуждения и на импульсы небольшой силы.
Автоматия сердца и ее природа. Структурно-функциональные особенности атипических мышечных клеток
Возбуждение в сердце возникает периодически под влиянием процессов, протекающих в нем самом. Эта способность сердца сокращаться под действием импульсов, возникающих в самой ткани без внешних воздействий, получила название автоматии.
Показателем автоматии сердечной мышцы может быть тот факт, что изолированное сердце лягушки, удаленное из организма и помещенное в физиологический раствор, может в течение длительного времени ритмически сокращаться.
Способностью к автоматии обладают определенные участки миокарда, состоящие из специфической (атипической) мышечной ткани, бедной миофибриллами, богатой саркоплазмой и напоминающей эмбриональную мышечную ткань. Специфическая (атипическая) мускулатура образует в сердце проводящую систему.
Помимо специфической ткани, в миокарде сердца есть и неспецифическая (типическая) мышечная ткань. По строению она сходна с поперечно-полосатой скелетной мышечной тканью и образует рабочую часть миокарда.
В клетках специфической ткани находится большое количество межклеточных контактов — нексусов. Эти контакты являются местом перехода возбуждения с одной клетки на другую. Такие же контакты имеются и между клетками атипической ткани и рабочего миокарда. Благодаря наличию контактов миокард, состоящий из отдельных клеток, работает как единое целое. Существование большого количества межклеточных контактов увеличивает надежность проведения возбуждения в миокарде.
В миокарде различают два вида сократительных элементов — типическую и атипическую мускулатуры. Типическая мускулатура обеспечивают сократительную функцию миокарда, атипическая обладают сократительными способностями значительно в меньшей степени, так как главная функция последней – это проведение возбуждения в сердце. Структурно она отличается от типической мускулатуры тем, что в ней мало сократительных элементов, но она богата различными включеньями (гликоген и др.) Структурно атипические волокна напоминают эмбриональную мышечную ткань. Они обеспечивают сердцу очень важное свойство, которое называется автоматией. Клетки атипической мускулатуры, способные к самовозбуждению, называются пейсмеккеры, что в переводе обозначает “водитель”.
Атипические мышечные волокна находятся в сердце в виде скоплений — узлов и пучков, а также разбросаны диффузно по всему миокарду Так у млекопитающих, у человека между впадением полых вен в правое предсердие находится скопление атипических клеток в виде узла, называемый синоатриальным узлом (или узел Кисс-Флякка). Его ещё называют узлом I-го порядка или ведущим, потому что в нем периодически самопроизвольно генерирует потенциал действия, вызывающий возбуждение сердечной мышцы. Размеры узла: длина — 2-3 см, толщина — 2-3 мм.
Второй узел находится на правой предсердно-желудочной перегородке. Это атривентрикулярный узел или узел Ашоф-Тавара. Функционально он рассматривается как узел II-го порядка. В норме он только проводит возбуждение, поступающее от синоатриального узла. В случае же выключения ведущего узла генераторную функцию берет на себя атривентрикулярный узел, который обеспечивает автоматические возбуждения и сокращения миокарда. Синоатриальный и атривентрикулярный узлы связаны друг с другом тремя основными пучками, состоящими из атипической мускулатуры (пучки Бахмана, Венкебаха, Торелла).
Проводящая система сердца, ее структура, функции. Представление об убывающем градиенте автоматии
Проводящая система сердца представлена тремя узлами — водителями ритма: синусно-предсердный, или синоатриальный, узел расположен в стенке правого предсердия в устье полых вен; предсердно-желудочковый узел, атриовентрикулярный узел, расположенный в нижней трети правого предсердия и межжелудочковой перегородке; от этого узла берет начало предсердно-желудочковый пучок (пучок Гиса), прободающий предсердно-желудочковую перегородку и делящийся на правую и левую ножки, следующие в межжелудочковой перегородке. В области верхушки сердца ножки пучка Гиса загибаются вверх и переходят в сеть сердечных проводящих миоцитов (волокна Пуркинье), погруженных в рабочий (сократительный) миокард желудочков. Проводящая система сердца, как уже говорилось, обладает автоматиеи.
Особенностью проводящей системы сердца является способность каждой клетки самостоятельно генерировать возбуждение. Существует так называемый градиент автоматии, выражающийся в убывающей способности к автоматии различных участков проводящей системы по мере их удаления от синусно-предсердного узла, генерирующего импульсы с частотой до 60-80 в минуту.
В обычных условиях автоматия всех ниже расположенных участков проводящей системы подавляется более частыми импульсами, поступающими из синусно-предсердного узла. В случае поражения и выхода из строя этого узла водителем ритма может стать предсердно-желудочковый узел. Импульсы при этом будут возникать с частотой 40-50 в минуту. Если окажется выключенным и этот узел, водителем ритма могут стать волокна пучка Гиса. Частота сердечных сокращений в этом случае не превысит 30-40 в минуту. Если выйдут из строя и эти водители ритма, то процесс возбуждения спонтанно может возникнуть в клетках волокон Пуркинье. Ритм сердца при этом будет очень редким — примерно 20 в минуту.
Доказательством разной активности водителей ритма является опыт Станниуса с наложением лигатур — перевязок. В опыте на лягушке с помощью лигатуры отделяется часть предсердия вместе с синоатриальным узлом от остальной части сердца. После этого все сердце перестает сокращаться, а отделенный участок предсердия продолжает сокращаться в том же ритме, что и до наложения лигатуры. Это свидетельствует о том, что синоатриальный узел является ведущим, от него зависит частота сердечных сокращений. Станниус назвал этот узел водителем ритма 1-го порядка.
Через 20-30 мин после наложения лигатуры на сердце лягушки проявляется автоматия атриовентрикулярного узла: сердце начинает сокращаться, но в более редком ритме, чем до наложения лигатуры, причем предсердия и желудочки сокращаются одновременно. Атриовентрикулярный узел был назван водителем ритма 2-го порядка. Иногда для включения атриовентрикулярного узла требуется наложить вторую лигатуру, вызвав таким образом механическое раздражение водителя ритма 2-го порядка.
Если на сердце теплокровного животного создать блок между атриовентрикулярным узлов и пучком Гиса, то верхушка сердца будет сокращаться в еще более редком ритме, который зависит от автоматам пучка Гиса или волокон Пуркинье. Наложение третьей лигатуры на верхушку сердца показывает, что в ней отсутствует атипическая ткань, следовательно, она не сокращается, не обладает автоматией.
Свойства проводящей системы сердца обеспечивают:
1) автоматию сердца;
2) надежность работы сердца — при повреждении основного водителя ритма его в какой-то степени могут заменить другие отделы проводящей системы сердца, так как они тоже обладают автоматией;
3) последовательность сокращений предсердий и желудочков за счет атриовентрикулярной задержки;
4) синхронное сокращение всех отделов желудочков, что увеличивает их мощность.
Градиент автоматии — это убывание частоты генерации возбуждения в проводящей системе сердца в направлении от предсердий к верхушке. Наличие градиента автоматии доказал Г. Станниус (1880) в опыте с накладыванием лигатур между различными отделами сердца лягушки и последующим подсчетом сокращений различных отделов
сердца. Водителем ритма сердца является синоатриальный узел. Находясь под влиянием экстракардиальных нервов, он определяет ЧСС 60—80 в 1 мин.
Электрические явления в сердце. Характеристика потенциала покоя и потенциала действия кардиомиоцитов. Особенности проведения возбуждения по миокарду
Деятельность сердца, как и деятельность любой возбудимой ткани, сопровождается электрическими явлениями. Метод регистрации электрических явлений в работающем сердце получил название электрокардиографии. Чувствительный прибор, с помощью которого регистрируют электрические явления в возбужденном сердце, называют электрокардиографом.
Разница потенциалов, возникающая в возбужденном сердце, регистрируется в виде электрокардиограммы (ЭКГ).
В сердце здорового человека на электрокардиограмме отчетливо видны пять зубцов, из которых три обращены вверх (PRT), а два вниз (QS). Зубец Р отражает электрические явления в предсердиях, а зубцы QRST характеризуют движение волны возбуждения в желудочках сердца.
Электрокардиография — один из наиболее важных методов объективной регистрации деятельности сердца у взрослых.
Как в нервных клетках и в волокнах скелетных мышщ, потенциал действия(ПД) в кардиомиоцитах начинается с быстрой реверсии мембранного потенциала от уровня покоя (примерно —90 мВ) до пика ПД (примерно +30 мВ). За этой фазой быстрой деполяризации, продолжительность которой составляет лишь 1-2 мс, следует более длительная фаза плато — специфическая особенность клеток миокарда. Затем наступает фаза реполяризации, по окончании которой восстанавливается потенциал покоя. Длительность потенциала действия кардиомиоцитов составляет 200-400 мс, т. е. более чем в 100 раз превышает соответствующую величину для скелетных мышц и нервных волокон. Как будет показано ниже, это имеет большое функциональное значение.
Ионные механизмы возбуждения.Потенциал действия возникает в результате изменений мембранного потенциала, проницаемости для различных ионов и ионных потоков. Основы ионной теории возбуждения подробно рассмотрены в гл. 1; здесь же мы кратко остановимся на некоторых положениях этой теории применительно к особенностям клеток миокарда.
Потенциал покоя этих клеток создается преимущественно за счет К+ -потенциала, поддерживаемого благодаря работе электрогенного натриевого насоса. Как и в нервных клетках, быстрая восходящая фаза ПД кардиомиоцитов обусловлена коротким, но значительным повышением проводимости для натрия (gNa), что приводит к лавинообразному входу Na+ .
Однако этот начальный входящий ток Na+ быстро инактивируется (в этом кардиомиоциты также сходны с нервными клетками), поэтому значительное замедление реполяризации в клетках миокарда обусловлено иными механизмами. К ним относятся Π медленно развивающееся увеличение проводимости для Ca2 + (gCa), в результате которого возникает деполяризующий входящий ток кальция (медленный входящий ток); 2) снижение проводимости для К+ (gK), возникающее при деполяризации и уменьшающее реполя- ризуюший выходящий ток К+.
Реполяризация в клетках миокарда обусловлена постепенным уменьшением gCa, а также тем, что при увеличении отрицательного мембранного потенциала повышается gK. Уменьшение gCa приводит к снижению медленного входящего тока, а повышение gK — к увеличению выходящего тока К+. В состоянии покоя деполяризующие и реполяризующие токи находятся в равновесии.
Механизмы, лежащие в основе этого медленного входящего тока Са2+ и быстрого входящего тока Na+, различаются по многим параметрам, в том числе по временному ходу, зависимости от потенциала и чувствительности к блокирующим агентам. Так называемый быстрый натриевый канал блокируется тетродотоксином, а медленный кальциевый ионами Cd2+ и органическими антагонистами Са2+ (например, верапамилом, нифедипином, дилтиаземом). Порог активации натриевого канала равен примерно —60 мВ, а кальциевого — около —30 мВ. При деполяризации мембраны до —40 мВ быстрый натриевый канал инактивируется. При этом под действием сверхпороговых раздражителей могут возникать так называемые кальциевые потенциалы действия,
имеющие более пологий передний фронт (так как медленный входящий ток в этом случае обусловливает не только плато, но и передний фронт ПД) и меньшую скорость распространения («медленный ответ»).
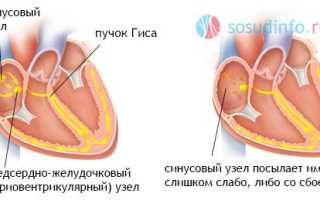
Причины слабости синусового узла
Ранее понятия дисфункции и слабости синусового узла объединялись, но в настоящее время принято считать, что дисфункция является состоянием потенциально обратимым и вызвана функциональными расстройствами, в то время как синдром слабости узла обусловлен органическим поражением миокарда в области водителя ритма.
Причины дисфункции синусового узла (чаще встречается в детском возрасте и у подростков):
- Возрастная инволюция синусового узла – уменьшение активности пейсмекерных клеток вследствие возрастных особенностей,
- Возрастная или врожденная дисфункция отделов вегетативной нервной системы, проявляющаяся не только нарушением регуляции синусовой активности, но и изменением тонуса сосудов, вследствие чего имеет место понижение или повышение артериального давления.
Причины синдрома слабости синусового узла (СССУ) у детей:
- Амилоидоз с поражением сердечной мышцы – откладывание в миокарде патологического белка – амилоида,
- Аутоиммунное поражение сердечной мышцы вследствие системных процессов – системная красная волчанка, ревматизм, системная склеродермия,
- Поствирусные миокардиты – воспалительные изменения в толще сердечной мышцы, захватывающие правое предсердие,
- Токсическое влияние некоторых веществ – антиаритмические препараты, фосфороганические соединения (ФОС), блокаторы кальциевых каналов (верапамил, дилтиазем и др) – как правило, клинические проявления исчезают после прекращения действия вещества и проведения дезинтоксикационной терапии.
Причины слабого синусового узла во взрослом возрасте (как правило, у лиц старше 50 лет) – кроме возможных перечисленных выше состояний, наиболее часто развитие заболевания провоцируют:
- Ишемическая болезнь сердца, вследствие чего нарушается кровоток в области синусового узла,
- Перенесенные инфаркты миокарда с последующим развитием рубцовых изменений, затрагивающих область синусового узла.
Есть много факторов, которые могут вызывать синдром слабости синусового узла. Все они разделяются на две большие категории: первичные и вторичные или внутренние и внешние соответственно. Рассмотрим каждую из этих групп отдельно.
Суть первичных причин, которые провоцируют развитие СССУ, заключается в поражении синусового узла или всей мышцы в целом. К таким причинам относятся следующие проблемы:
- ишемическое заболевание;
- кардиомиопатия (гипертоническая, гипертрофическая);
- миокардит;
- сердечные пороки;
- оперативное вмешательство или получение травм, которые приходятся на сердце;
- недуги соединительной ткани, которые могут быть аутоиммунными и дегенеративными;
- идиопатическая слабость синусового узла, которая не имеет причины;
- гипертрофическая кардиомиопатия, при которой в левом желудочке стенка становится более широкой.
К вторичным или внешним причинам, вызывающим образование СССУ, относятся негативные изменения в организме, которые оказывают влияние на работу сердца. К таким проблемам относятся следующие моменты:
- нарушения в эндокринной системе;
- дистрофия и истощение организма;
- сифилис в третичной форме;
- расстройства электролитного характера;
- нарушение дозировки препаратов, которые способны оказывать замедляющее воздействие на работу сердца;
- рефлекторные вагусные расстройства;
- интоксикация в результате приёма токсических препаратов или наличия в организме внутренних токсинов.
Более подробно хотелось бы обсудить причины, которые приводят к СССУ, а также классификации этого синдрома. Есть две главные группы факторов, которые могут привести к дисфункции синусового узла.
- Состояния и заболевания, которые вызывают изменения в структуре клеток или изменения сократительного миокарда предсердий, окружающего узел. Эти поражения можно назвать внутренними теологическими факторами. К данным поражениям можно отнести несколько форм. Например, идиопатические инфильтративные и дегенеративные заболевания. Самая распространенная органическая причина синдрома — склеродегенеративный изолированный фиброз узла синусового вида. С возрастом окружающий СА-узел миокарда замещается фиброзной тканью. Если фиброз прогрессирует, автоматизм снижается, как и синоартериальная проводимость. Возможно, у некоторых пациентов такое состояние детермировано генетически.
ИБС также может стать причиной слабости узла, причем причиной может служить как хроническая ИБС, также и острый инфаркт миокарда. Дисфункция узла при данном заболевании развивается в острой форме при тромбозе, который поражает артерии, питающие этот узел.
В связи с этим инфаркт миокарда острой формы, имеющий боковую или нижнюю локализацию, может быть осложнен прекращением активности узла или выраженной брадикардией. Обычно такие аритмии имеют временный характер.
Кардиомиопатии также являются причиной СССУ. Причем это касается разных форм.
Например, имеют место воспалительные неспецифические кардиомиопатии. Риск развития СССУ особенно высок тогда, когда кардиомиопатии сочетаются с перикардитом.
Часто нарушения проводимости исчезают. Также стоит сказать об инфильтивных кардиомиопатиях.
Они развиваются при опухолевых заболеваниях, гемохроматозе и амилоидозе. Причиной могут служить и другие кардиомиопатии.
СССУ также может развиваться из-за артериальной гипертензии, гипотиреоза, хирургической травмы и нарушения костно-мышечной системы.
- Вторая группа — внешние факторы, которые приводят к нарушению функции узла тогда, когда отсутствуют морфологические изменения. Здесь также можно выделить две группы. Первая группа — лекарственные препараты, которые снижают функция узла. Они включают в себя бета-блокаторы, исключая дилтиазем и верапамил, сердечные гликозиды, антиаритмические мембраноактивные препараты, относящиеся к 1С и 1А классам, а также препараты, которые не так часто снижают функцию, например, фенитоин, циметидин и так далее.
Вторая группа — вегетативная дисфункция узла синусового вида. Она связана с слишком сильной активацией блуждающего нерва, из-за чего синусовый ритм становится реже, а рефрактерный период узла удлиняется.
Тонус блуждающего нерва может повышаться физиологическим путем, то есть при мочеиспускании, кашле, дефекации, глотании, пробе Вальсальвы, рвоте, тошноте и во время сна. Повышение тонуса может иметь и патологический характер.
Речь идет о заболеваниях органов пищеварительного тракта, глотки, мочеполовой системы и так далее. Обычно такая группа внешних факторов встречается в молодом возрасте и сочетается со значительной невротизацией и синдромом мезенхиальной дисплазии.
Синусовая брадикардия стойкого характера может наблюдаться у натренированных атлетов из-за того, что сильно преобладает вагусный тонус. Это явления не является признаком СССУ.
Симптомы заболевания
Клинические признаки слабости синусового узла зависят от типа и степени возникающих нарушений в его работе. Так, по типу клинико-электрокардиографических изменений выделяют:
- Упорную выраженную брадикардию,
- Синдром «тахи-бради» – чередующиеся приступы редкого и быстрого сердцебиения,
- Брадисистолическую форму мерцательной аритмии – это состояние, которое характеризуется тем, что функции водителя ритма на себя берут мельчайшие участки электрически активной ткани в предсердиях, но вследствие этого мышечные волокна предсердий сокращаются не синхронно, а хаотично, так еще и реже, чем должно быть в норме,
- Синоаурикулярную (синоатриальную) блокаду – состояние, при котором возникает блок для проведения импульсов либо в самом узле, либо на выходе из него.
Клинически брадикардия начинает проявляться, когда частота сердечных сокращений составляет менее 45 – 50 ударов в минуту. К симптомам относятся повышенная утомляемость, головокружение, резкая слабость, мелькание мушек перед глазами, предобморочное состояние, особенно при физической нагрузке. При ритме менее 40 развиваются приступы МЭС (МАС, Морганьи – Адемса – Стокса) – потери сознания, обусловленные резким снижением поступления крови в головной мозг. Опасность таких приступов в том, что в это время период отсутствия электрической активности сердца составляет более 3-4 секунд, что чревато развитием полной асистолии (остановки сердца) и клинической смерти.
Синоаурикулярная блокада I степени клинически никак себя не проявляет, а вот II и III степени характеризуется приступами головокружения и обмороками.
Синдром тахи-бради проявляется резкими ощущениями перебоев в работе сердца, чувством учащенного сердцебиения (тахикардии), а затем резким замедлением пульса, вызывающего головокружение или обморок. Подобными нарушениями проявляется и мерцательная аритмия – резкие перебои в сердце с последующей потерей сознания или без нее.
Фазы возбуждения сердца
При возбуждении возбудимость тканей меняется, проходя через следующие фазы:
- фаза абсолютной рефрактерности,
- фаза относительной рефрактерности,
- фаза экзальтации.
В сердечной мышце фаза абсолютной рефрактерности:
- продолжается немного дольше, чем в скелетной;
- длится всю систолу и захватывает начало диастолы.
Затем возбудимость миокарда постепенно восстанавливается до исходного уровня — это период относительной рефрактерности.
В период абсолютной рефрактерности сердечная мышца способна отвечать на сильный сверхпороговый раздражитель.
В сердце может возникать внеочередное сокращение — экстрасистола.
После экстрасистолы наступает удлиненная пауза между нею и следующей очередной систолой желудочков — компенсаторная пауза. Данная экстрасистола называется также желудочковой экстрасистолой.
Причиной компенсаторной паузы является то, что очередной импульс из синоатриального узла приходит в желудочки в тот момент, когда желудочки находятся в фазе абсолютной рефрактерности, возникшей во время экстрасистолы.
Предсердная экстрасистола — не сопровождается компенсаторной паузой; после нее происходит укорочение диастолы. В результате типичные кардиомиоциты не способны к тетанусу.
В сердце не может возникнуть тетаническое сокращение, что обеспечивает нагнетательную функцию сердца.
В типичных кардиомиоцитах:
- высокий уровень МП — 80-90 мВ,
- высокий уровень ПД (в желудочках до 120 мВ),
- длительность ПД в желудочках 330 мс (0,33 с);
- в предсердиях — 100 мс (0,1 с).
В ПД желудочков 5 фаз:
- 0-нулевая фаза быстрой деполяризации,
- 1-фаза быстрой начальной реполяризации,
- 2-фаза плато,
- 3-фаза быстрой конечной реполяризации,
- 4-диастолический потенциал в период покоя, между ПД.
Фаза деполяризации: поступает Na в клетку, возникает состояние абсолютной рефрактерности.
Фаза быстрой начальной реполяризации: вход в клетку Cl.
Деполяризация вызывает активацию медленных Na и Ca каналов.
Поток Na и Ca приводит к развитию плато, так как их входу в клетку противодействует выход из клетки K и потенциал не меняется.
В период плато:
- быстрые Na каналы инактивированы,
- миокард находится в состоянии абсолютной рефрактерности.
Фаза конечной реполяризации:
- медленные Na и Ca каналы закрываются,
- поток выходящих ионов K усиливается.
Реполяризация вызывает постепенное закрытие K каналов и активацию Na каналов, следовательно, возбудимость постепенно восстанавливается — это период относительной рефрактерности.
Проводимость миокарда:
- предсердий — 1 м/с,
- желудочков — 0,8-0,9 м/с.
В пучке Гиса — 1-1,5 м/c, в волокнах Пуркинье — 3 м/c.
Заболевания, связанные с атриовентрикулярным узлом
Блокада атриовентрикулярного узла
Наиболее распространенным атриовентрикулярным расстройством является AV-блокада. Это сердечная аритмия, развивающаяся из-за запаздывающей или прерванной передачи сигналов через атриовентрикулярный узел. Часто блокада остается незамеченной и в таких случаях обычно определяют соответствие блокаде первой степени. Однако тяжелая AV-блокада заставляет сердце биться очень медленно. Это явление вызывает так называемую брадикардию, которая иногда переходит во временную остановку сердца со всеми вытекающими последствиями. Для лечения таких состояний обычно используется кардиостимулятор, который стабилизирует нарушенную передачу импульсов. При таком серьезном нарушении работы АВ-узла говорят о AV-блокаде третьей степени.
Блокада AV-узла может быть диагностирована с помощью ЭКГ, где она выражается в удлиненном интервале PQ, в зависимости от степени тяжести. Врожденные АВ-блокады встречаются чрезвычайно редко, но могут определяться как часть другой врожденной болезни сердца. Большинство AV-блокад являются приобретенными. Они обычно возникают в результате дегенеративных изменений сердца. Например, воспаление или инфекция сердечной мышцы могут способствовать образованию блокады. Больные с этим заболеванием сначала лечатся медикаментозно для устранения аритмии. При ухудшении состояния больным с блокадой AV-узла 2 и 3 степени обычно имплантируется кардиостимулятор, поскольку медикаментозная терапия считается ненадежной при выраженных симптомах.
Ускоренная проводимость между предсердиями и желудочками
Противоположностью AV-блокаде является ускоренная проводимость между предсердиями и желудочками. Это явление нередко определяется на фоне синдрома Вольфа-Паркинсона-Уайта. При этой сердечной аритмии обычно определяется один или несколько дополнительных путей проведения, сообщающих желудочки и предсердия в обход АВ-узла. Ускоренная передача обычно проявляется значительным увеличением пульса, также при ней может определяться тахикардия, то есть учащенное биение сердца.
В большинстве случаев тахикардия может регулироваться самим пациентом. Например, сердцебиение и ритм сердца немного останавливаются при задержке воздуха на выдохе. Кроме того, врач обычно назначает пациентам с тахикардией соответствующие препараты по типу аджмалина. В отличие от замедленной передачи возбуждения синусового узла, хирургическая имплантация кардиостимулятора при ускоренной проводимости и тахикардии в большинстве случаев не проводится.
Атриовентрикулярная узловая ре-ентри тахикардия
Может возникать внезапно и сопровождаться увеличением нормальных сердечных сокращений между патологическими. Симптомы могут длиться от нескольких минут до нескольких дней, а некоторые больные вообще не отмечают никаких признаков.
Ре-ентри тахикардия становится проблемой, когда она возникает часто и длительно продолжается, особенно на фоне других повреждений сердца.
Основными признаками болезни является:
- Трепетание в груди
- Частое сердцебиение
- Сбивчивое дыхание
- Головокружения
- Потение
- Тяжесть в шее
- Обморок или предобморочное состояние
Самые распространенные типы ре-ентри тахикардии:
- Атриовентрикулярная узловая ре-ентри тахикардия (AVNRT). Встречается у мужчин и женщин любого возраста, хотя чаще наблюдается у молодых женщин.
- Атриовентрикулярная возвратно-поступательная тахикардия (AVRT). Является вторым по встречаемости типом ре-ентри тахикардии. Чаще всего диагностируется у молодых людей.
В лечении клинически выраженной патологии в начале используют консервативное лечение. При этом очень важно принимать любые антиаритмические препараты точно так, как это предписано доктором, чтобы свести к минимуму осложнения. Если лекарства не помогают, используют катетерную абляцию. В ходе этой процедуры врач направляет один или несколько катетеров через кровеносные сосуды к сердцу. Электроды на кончиках катетера могут воздействовать на ткани теплом, экстремально низкими температурами или радиочастотной энергией. Это позволяет повредить небольшой участок миокарда и создать электрический блок вдоль пути, который являлся причиной аритмии.
Иногда лечение ре-ентри тахикардии основывается на использовании небольшого имплантируемого прибора, называемого кардиостимулятором, который генерирует электрические импульсы, стимулирующие сердце биться в нормальном ритме. Кардиостимулятор располагается под кожей в районе ключицы во время незначительного хирургического вмешательства. Изолированный провод направляется от устройства к сердцу, где он закрепляется на постоянное время.
Кистозная опухоль атриовентрикулярного узла
Первичные кардиальные опухоли являются редкими заболевания, определяемыми с частотой от 0,0017% до 0,03% от общего количества.
Кистозная опухоль атриовентрикулярного (AV) узла, также известна как мезотелиома AV-узла, является доброкачественной врожденной опухолью, которая расположена в треугольнике Коха в AV-узловой области межпредсердной перегородки сердца.
AV-узловая область образуется во время эмбрионального слияния, при нарушении которого ткани преобразоваться в подобную опухоль. Исследования показали, что у 10% людей с кистозной опухолью AV-узла также имеются дефекты развития средней линии вдоль центральной оси вертикального тела (1,9), что указывает на генетический дефект, связанный с миграцией эмбриологических тканей и с неблагоприятной наследственностью. Было высказано предположение, что, в отличие от настоящего новообразования, это, скорее всего, результат дилатации кистозных пространств, а не клеточной репликации. В дополнение отсутствуют митозы этой опухоли
Поскольку имплантация кардиостимулятора не предотвращает внезапную смерть у больных с этой опухолью, чаще всего проводится хирургическое вмешательство. Существуют различные способы иссечения области поражения, однако из-за редкости кистозной опухоли AV-узла в сочетании со сложностью диагностики поражения методы хирургической резекции и терапевтические концепции до конца не стандартизированы. Например, остается спорным вопрос, должно ли поражение полностью или частично удаляться от основания межпредсердной перегородки.
Прогноз при кистозной опухоли AV-узла благоприятен при ранней диагностики с последующим оперативным и полным хирургическим удалением патологического образования. Случаи внезапной сердечной смерти показали, что эта опухоль связана с фатальной сердечной дисритмией и частичной / полной блокадой сердца. Таким образом, несмотря на то, что опухоль доброкачественна, большинству больным ставиться окончательный диагноз после вскрытия. Дополнительно стоит указать, что размер опухоли, по-видимому, не связан с симптомами летальной аритмией или внезапной смертью.
Нарушение внутрижелудочковой проводимости сердца: симптомы, диагностика, лечение
Чтобы понять, как именно развиваются такие патологические состояния, необходимо знать, из чего именно состоит проводящая система, отвечающая за передачу импульсов по желудочкам. Так, ведущая роль в данном процессе принадлежит так называемому пучку Гиса, состоящего из двух структурных частей:
- Левая ножка. Представлена передней и задней ветвью, каждая из которых отвечает за свою стенку в левом желудочке. Их разветвления образуют систему волокон Пуркинье.
- Правая ножка. Представлена одним пучком, разветвляющимся в нижних отделах правого желудочка.
Для возникновения возбуждения в желудочках, импульс из водителя ритма проходит по межжелудочковой перегородке и затем происходит одновременное возбуждение обоих желудочков. Чтобы это произошло, импульсу нужно приблизительно 0,12 секунды.
В том случае, если отмечаются блокады на каком-то из путей проведения, меняется не только путь, по которому проходит импульс, но и время, за которое происходит возбуждение желудочков.
Согласно общепринятой классификации, все блоки проведения импульса к желудочкам разделяют следующим образом:
- Одно-, двух-, или трехпучковые. Это определяется тем, сколько именно пучков задействовано в неправильном проведении импульсов.
- Локальные. Нарушение проведения отмечается не во всех отведениях при ЭКГ обследовании.
- Переходящие. Неправильное проведение импульса чередуется с нормальным.
- Арборизационные. Блокада импульса происходит в волокнах Пуркинье. Точнее говоря, в их нижних отделах.
- Полные блокады.
- Неполные блокады.
- Альтернирующие блокады. При проведении исследований выявляется то один, то другой вариант.
Болезни сердца и сосудов чрезвычайно распространены в последнее время. То же относится и к нарушению ритма сердечной деятельности (аритмии). К данной патологии относится и описываемое нарушение.
Сегодня мы с вами поговорим про нарушение внутрижелудочковой проводимости что это такое выясним, рассмотрим причины возникновения и методы лечения.
Что такое нарушение внутрижелудочковой проводимости сердца?
Этим термином принято называть патологические нарушения одного, двух или всех 3трех пучков внутрижелудочковой проводящей системы. Это, так называемые, моно-, би- и трифашикулярные блокады соответственно.
При этом нужно понимать, что нарушение проводимости нервного импульса не означает обязательного его отсутствия. Это говорит лишь о том, что существует нарушение в проводящей системе, которое может проявиться в замедлении импульсов, когда происходит урежением ритма. Либо проявляется в полном прекращении нервных импульсов и тогда происходит полная остановка сердца.
Как вы понимаете, нарушение внутрижелудочковой проводимости, характеризуется наличием блокад сердца. Они, в свою очередь, разделяются на полные и неполные. При полных прохождение нервного импульса отсутствует, при неполных — нервные импульсы проводятся с меньшей частотой.
Кроме того данная патология классифицируется по участку поражения. Например, произошла блокада правой или левой ножки пучка Гисса. Также блокады подразделяют на проксимальные и дистальные. Причем, дистальные блокады считаются менее благоприятными, поэтому при таком нарушении требуется повышенное внимание со стороны лечащего врача.
Почему возникает эта патология?
Существуют три основные причины, вызывающие нарушение внутрижелудочковой проводимости. Это органические, функциональные и лекарственные причины.
При органических — изменяются структуры проводящей системы сердца. Данные изменения часто сопровождают миокардиты, инфаркт, стенокардию, кардиосклероз и другие ишемические заболевания сердца. Кроме того органические изменения наблюдаются при врождённых пороках сердца, кардиомиопатиях, иногда после оперативных вмешательств.
При функциональных — наблюдаются изменения работы проводящей системы. При этом отсутствует патология ССС. Проводящая система регулируется симпатической и парасимпатической системами.
Первая увеличивает проводимость импульса, а вторая, наоборот, замедляет. В норме они работают слаженно, дополняя друг друга.
Лекарственные причины наблюдаются при приеме некоторых препаратов, которые влияют на ритмику сердца, вызывая отклонения. Блокады этой группы отличаются тяжестью течения и тропидностью (трудно поддаются лечению).
Нарушение внутрижелудочковой проводимости выявляется при проведении электрокардиографии. В случае имеющихся преходящих нарушений проводится специальный метод ЭКГ — холтеровское мониторирование.
— Увеличенное, учащенное сердцебиение;— Периодически наблюдаются пропуски сердечного сокращения;— Наличие перебоев при работе сердечной мышцы;— Стенокардитические сердечные боли;
— Наличие одышки, головокружения, обмороки. Эти симптомы связаны с недостаточным снабжением кровью головного мозга.
- При наличии описанных признаков, также как и при любых других отклонениях в сердечной деятельности, обратитесь к врачу кардиологу или аритмологу.
- Лечение нарушение внутрижелудочковой проводимости
- При наличии блокад, при которых атриовентрикулярная проводимость не нарушена, терапия заключается в выявлении и лечении основного заболевания.
При внутрижелудочковых блокадах, а также при сердечной недостаточности для лечения используют сердечные гликозиды. Их назначают всем больным с данной патологией. В случаев, когда внутрижелудочковая блокада наблюдается одновременно с атриовентрикулярной блокадой I — II степени, указанные препараты назначают с особой осторожностью при регулярном электрокардиографическом контроле.
При острых бифасцикулярных блокадах у больных инфарктом миокарда в профилактических целях вводят зонд (правый желудочек), так как существует высокая вероятность полной трифасцикулярной блокады и остановки кровообращения.
Нужно помнить, что острые монофасцикулярные блокады только в 12% случаев предшествуют нарушению атриовентрикулярной проводимости. Поэтому проводить катетеризацию сердца всем таким больным не целесообразно. Процедура проводится только при наличии реальной угрозы развития атриовентрикулярной блокады.
В случае трифасцикулярной блокады, при наличии нарушения атриовентрикулярной проводимости II и III степени, при необходимости, больным вводят зонд-электрод в полость правого желудочка.
В основном, лечение направлено на устранение причин, вызвавших тот или иной вид блокады. Далее проводится симптоматическое лечение данного нарушения.
Ведущая функция сердца и его миокарда (мышечных стенок) заключается в передаче по системе особых узлов и волокон электрических импульсов. Чтобы сердцебиение было достаточным для кровообращения, волны возбуждения должны передаваться по кардиальным отделам в определенной последовательности и с постоянной скоростью.
В норме импульсы проходят из синусового узла, синопредсердной части в атриовентрикулярную – предсердно-желудочковую. Таким образом, возбуждаются вначале верхние отделы, а затем нижние.
- Нарушение внутрижелудочковой проводимости — патология очагового (локального) характера, при которой нарушается проходимость электрического импульса в желудочках сердца (одной из частей проводящей системы).
- Импульс зарождается в синусовом узле, который является источником синусового ритма (считаются нормой сокращения сердца в диапазоне от 60 до 90 ударов в минуту), проходит через предсердия и атриовентрикулярный узел и попадает на пучок Гиса, разделяющийся на левую и правую ножки.
- Правая представляет собой разветвление в правом желудочке, а левая делится на переднюю и заднюю ветви, которые отвечают за сокращение передней и задней стенок левого желудочка.
- При нарушениях проводимости такого типа, импульс блокируется на пучках Гиса нарушая правильные сокращения желудочков.
В редких случаях заболевание бывает врожденным, и, обычно, не ухудшая качества жизни, случайно обнаруживается во время медицинского обследования.
Однако гораздо чаще его причиной становятся заболевания:
- атеросклероз;
- миокардит;
- ишемическая болезнь сердца;
- артериальная гипертензия;
- сердечная недостаточность;
- артериальная гипертензия;
- пороки сердца;
- кардиомиопатия;
- гипертрофия миокарда.
У новорожденных, грудничков, детей и подростков нарушение проводимости может спровоцировать:
- недоношенность;
- открытое овальное окно — отверстие между предсердиями, которое служит для кровоснабжения в период развития эмбриона. У родившегося ребенка оно закрывается в течение первого года жизни;
- врожденные патологии сердца;
- заболевания эндокринной системы (например, щитовидки, надпочечников, половой системы).
У детей и взрослых причинами также могут стать острые расстройства сердечной деятельности после интоксикации медикаментами или наркотиками, хирургические вмешательства.
Классификация
Классификация нарушений внутрижелудочковой проводимости опирается на внутреннее строение пучка Гиса.
| Виды | Локализация поражения |
| Однопучковые |
|
| Двухпучковые |
|
| Трехпучковые | Проводимость нарушена на уровне правой и левой ножек (на обеих ветвях). |
Профилактика заболеваний
В настоящее время каждый человек имеет какие-то проблемы со здоровьем. Это могут быть приобретенные заболевания или врожденные. К сожалению, не каждый человек сможет себе позволить регулярное лечение или оздоровительные мероприятия. Но это не означает, что нужно смириться с проблемами здоровья. Специалисты рекомендуют соблюдать некоторые правила, которые эффективны и нужны для того, чтобы предотвратить нарушение в работе этих органов. С помощью них можно не только поддерживать уровень здоровья, снизить риск появления новых, но также облегчить форму уже имеющихся заболеваний.
К таким правилам относятся:
- правильный режим дня;
- рациональное питание;
- отказ от вредных привычек;
- избегание стрессовых ситуаций;
- своевременное обращение к специалистам.
Выполнять такие правила не составит труда, но зато результат не заставит себя ждать. Самое главное, следить за систематичностью выполнения и научиться получать от них удовольствие.
Так мы узнали, где расположен синусно-предсердный узел, за что он отвечает, и как сохранить стабильную работу сердца долгие годы. Берегите себя, не болейте! А главное, следите за состоянием своего здоровья.
Структура сердца
Сердце состоит из четырех камер, разделенных специальными перегородками. Две камеры – это левое и правое предсердие. В правом предсердии расположен синусно-предсердный узел. Другие две камеры — левый и правый желудочки. Правая сторона сердца, куда входит правые предсердие и желудочек, отвечает за венозную кровь, а левая, где расположены левые предсердие и желудочек, за артериальную.
Между предсердиями и желудочками находится клапан, который не пускает кровь в обратную сторону. Также в сердце имеются полые вены, которые входят в правое предсердие, и легочные вены — в левое предсердие.
ФИЗИОЛОГИЯ СЕРДЦА
Самой главной функцией сердца является насосная, т. е. способность сердца непрерывно перекачивать кровь из вен в артерии, из большого круга кровообращения в малый. Цель этого насоса – доставлять кровь, несущую кислород и питательные вещества, ко всем органам и тканям, чтобы обеспечить их жизнедеятельность, забрать вредные продукты жизнедеятельности и донести их к обезвреживающим органам.
Сердце – это своеобразный вечный двигатель. В этом и последующих выпусках по физиологии сердца будут описаны сложнейшие механизмы, за счёт которых оно функционирует.
Выделяют 4 основные свойства сердечной ткани:
- Возбудимость – способность отвечать на действия раздражителей возбуждением в виде электрических импульсов.
- Автоматизм – способность самовозбуждаться, т. е. генерировать электрические импульсы в отсутствие внешних раздражителей.
- Проводимость – способность проводить возбуждение от клетки к клетке без затухания.
- Сократимость – способность мышечных волокон укорачиваться или увеличивать своё напряжение.
Средняя оболочка сердца – миокард – состоит из клеток, которые называются кардиомиоцитами. Кардиомиоциты не все одинаковы по своей структуре и выполняют различные функции. Выделяют следующие разновидности кардиомиоцитов:
- Сократительные (рабочие, типичные) кардиомиоциты составляют 99 % массы миокарда и обеспечивают непосредственно сократительную функцию сердца.
- Проводящие (атипичные, специализированные) кардиомиоциты . которые формируют проводящую систему сердца. Среди проводящих кардиомиоцитов различают 2 вида клеток – Р-клетки и клетки Пуркинье. Р-клетки (от англ. рale – бледный) обладают способностью периодически генерировать электрические импульсы, чем и обеспечивают функцию автоматизма. Клетки Пуркинье обеспечивают проведение импульсов ко всем отделам миокарда и имеют слабую способность к автоматизму.
- Переходные кардиомиоциты или Т-клетки (от англ. transitional — переходный) расположены между проводящими и сократительными кардиомиоцитами и обеспечивают их взаимодействие (т. е. передачу импульса от проводящих клеток к сократительным).
- Секреторные кардиомиоциты расположены преимущественно в предсердиях. Они выделяют в просвет предсердий натрийуретический пептид – гормон, регулирующий водно-электролитный баланс в организме и артериальное давление.
Все типы клеток миокарда не обладают способностью к делению, т. е. не способны к регенерации. Если у человека повышается нагрузка на сердце (например, у спортсменов), увеличение мышечной массы происходит за счёт увеличения объёма отдельных кардиомиоцитов (гипертрофии), а не их общего количества (гиперплазии).
Теперь рассмотрим подробнее строение проводящей системы сердца. Она включает в себя следующие основные структуры:
- Синоатриальный (от латинского sinus – пазуха, atrium – предсердие), или синусовый , узел расположен на задней стенке правого предсердия около устья верхней полой вены. Он образован P-клетками, которые посредством Т-клеток связаны между собой и с сократительными кардиомиоцитами предсердий. От синоатриального узла в направлении к атриовентрикулярному узлу отходят 3 межузловых пучка: передний (пучок Бахмана), средний (пучок Венкебаха) и задний (пучок Тореля).
- Атриовентрикулярный (от лат. аtrium – предсердие, ventriculum – желудочек) узел – расположен в зоне перехода от предсердных кардиомиоцитов к пучку Гиса. Содержит Р-клетки, но в меньшем количестве, чем в синусовом узле, клетки Пуркинье, Т-клетки.
- Предсердно-желудочковый пучок, или пучок Гиса (описан немецким анатомом В. Гисом в 1893 г.) в норме является единственным путём проведения возбуждения от предсердий к желудочкам. Он отходит от атриовентрикулярного узла общим стволом и проникает в межжелудочковую перегородку. Здесь пучок Гиса делится на 2 ножки – правую и левую, идущие к соответствующим желудочкам. Левая ножка делится на 2 ветви – передневерхнюю и задненижнюю. Ветви пучка Гиса заканчиваются в желудочках сетью мелких волокон Пуркинье (описаны чешским физиологом Я. Пуркинье в 1845 г.).
У некоторых людей встречаются дополнительные (аномальные) проводящие пути (пучок Джеймса, пучок Кента), которые участвуют в возникновении нарушений сердечного ритма (например, синдрома преждевременного возбуждения желудочков).
В норме возбуждение зарождается в синусном узле, переходит на миокард предсердий, и, пройдя атриовентрикулярный узел, распространяется по ножкам пучка Гиса и волокнам Пуркинье на миокард желудочков.
Таким образом, нормальный ритм сердца определяется активностью синоатриального узла, который называют водителем ритма первого порядка, или истинным пейсмекером (от англ. pacemaker – «отбивающий шаг»). Автоматизм присущ также другим структурам проводящей системы сердца. Водитель второго порядка локализован в атриовентрикулярном узле. Водителями третьего порядка являются клетки Пуркинье, входящие в состав проводящей системы желудочков.
Проводящая система сердца. Синусовый узел
В ее состав входят: (1) синусный узел (который также называют синоатриальным или С-А узлом), где и происходит ритмическая генерация импульсов; (2) предсердные межузловые пучки, по которым импульсы проводятся от синусного узла к агриовентрикулярному узлу; (3) атриовентрикулярный узел, в котором происходит задержка проведения импульсов от предсердий к желудочкам; (4) атриовентрикулярный пучок, по которому импульсы проводятся к желудочкам; (5) левая и правая ножки А-В пучка, состоящие из волокон Пуркинье, благодаря которым импульсы достигают сократительного миокарда.
Синусный (синоатриальный) узел
представляет собой небольшую эллипсовидную пластинку шириной 3 мм, длиной 15 мм и толщиной 1 мм, состоящую из атипических кардиомноцитов. С-А узел расположен в верхней части заднебоковой стенки правого предсердия у места впадения в него верхней полой вены. Клетки, входящие в состав С-А узла, практически не содержат сократительных филаментов; их диаметр всего лишь 3-5 мкм (в отличие от предсердных сократительных волокон, диаметр которых 10-15 мкм). Клетки синусного узла непосредственно связаны с сократительными мышечными волокнами, поэтому потенциал действия, возникший в синусном узле, немедленно распространяется на миокард предсердий.
Автоматия
— это способность некоторых сердечных волокон самостоятельно возбуждаться и вызывать ритмические сокращения сердца. Способностью к автоматии обладают клетки проводящей системы сердца, в том числе клетки синусного узла. Именно С-А узел контролирует ритм сердечных сокращений, как мы увидим далее. А сейчас обсудим механизм автоматии.
Механизм автоматии синусного узла
Необходимо отметить, что потенциал покоя клетки синусного узла имеет меньшую величину (от -55 до -60 мВ) в отличие от типичного кардиомиоцита (от -85 до -90 мВ). Это различие объясняется тем, что мембрана узловой клетки в большей степени проницаема для ионов натрия и кальция. Вход этих катионов в клетку нейтрализует часть внутриклеточных отрицательных зарядов и уменьшает величину потенциала покоя.
Прежде чем перейти к механизму автоматии, необходимо вспомнить, что в мембране кардиомиоцитов существуют три типа ионных каналов, которые играют важную роль в генерации потенциала действия: (1) быстрые натриевые каналы, (2) медленные Na+/Са2+-каналы, (3) калиевые каналы. В клетках миокарда желудочков кратковременное открытие быстрых натриевых каналов (на несколько десятитысячных долей секунды) и вход ионов натрия в клетку приводит к быстрой деполяризации и перезарядке мембраны кардиомиоцита. Фаза плато потенциала действия, которая продолжается 0,3 сек, формируется за счет открытия медленных Na+/Ca -каналов. Затем открываются калиевые каналы, происходит диффузия ионов калия из клетки — и мембранный потенциал возвращается к исходному уровню.
В клетках синусного узла
потенциал покоя меньше, чем в клетках сократительного миокарда (-55 мВ вместо -90 мВ). В этих условиях ионные каналы функционируют по-другому. Быстрые натриевые каналы инактивированы и не могут участвовать в генерации импульса. Дело в том, что любое уменьшение мембранного потенциала до -55 мВ на срок больший, чем несколько миллисекунд, приводит к закрытию инактивационных ворот во внутренней части быстрых натриевых каналов. Большая часть этих каналов оказывается полностью блокирована. В этих условиях могут открыться только медленные Na+/Ca -каналы, и поэтому именно их активация становится причиной возникновения потенциала действия. Кроме того, активация медленных Na/Ca -каналов обусловливает сравнительно медленное развитие процессов деполяризации и реполяризации в клетках синусного узла в отличие от волокон сократительного миокарда желудочков.